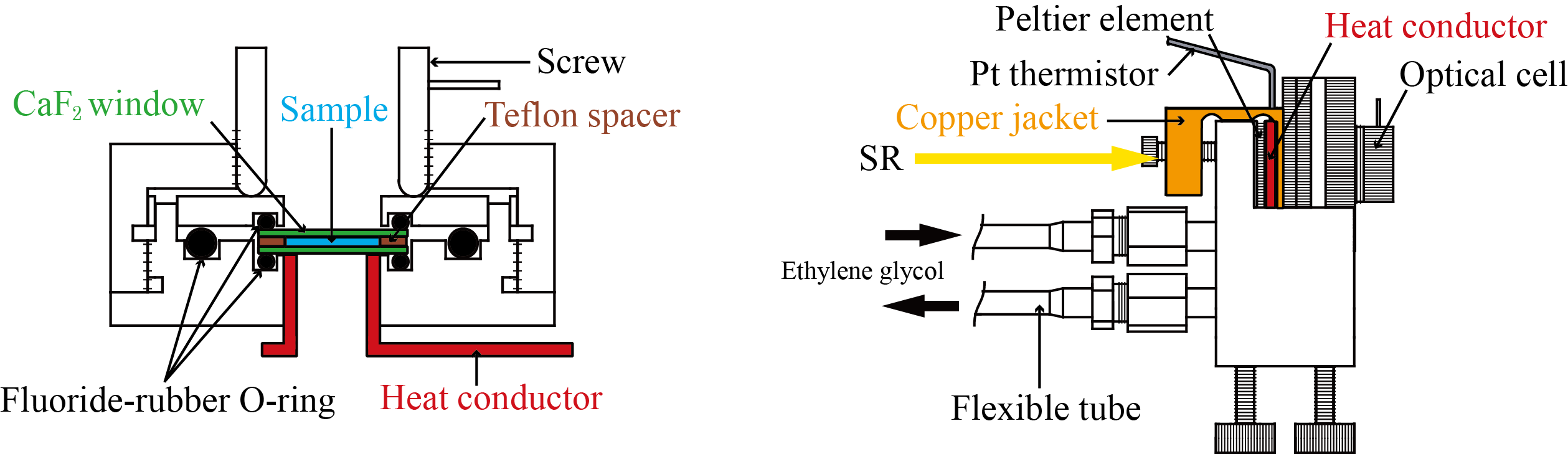
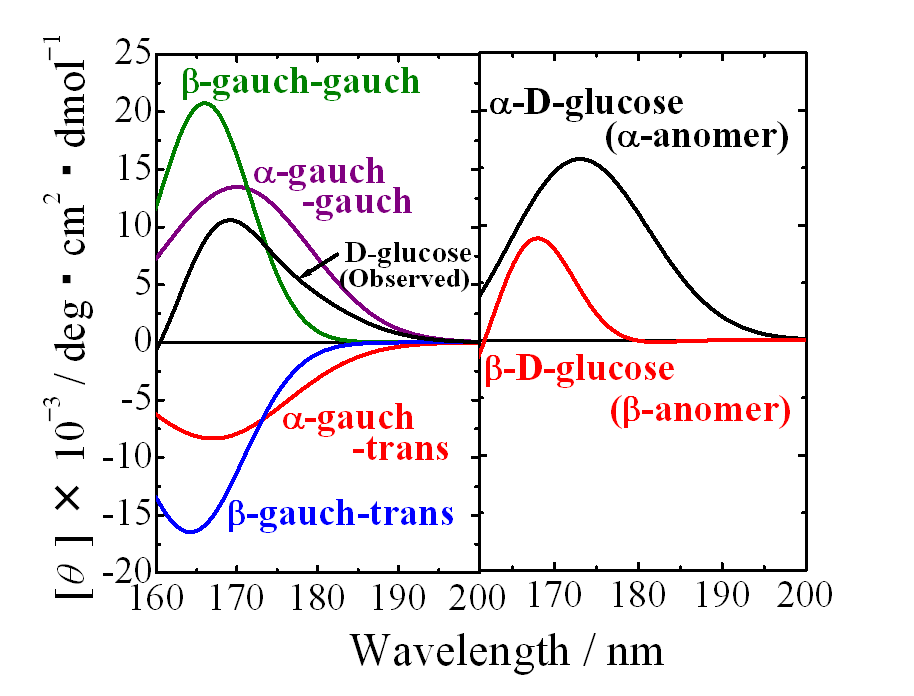
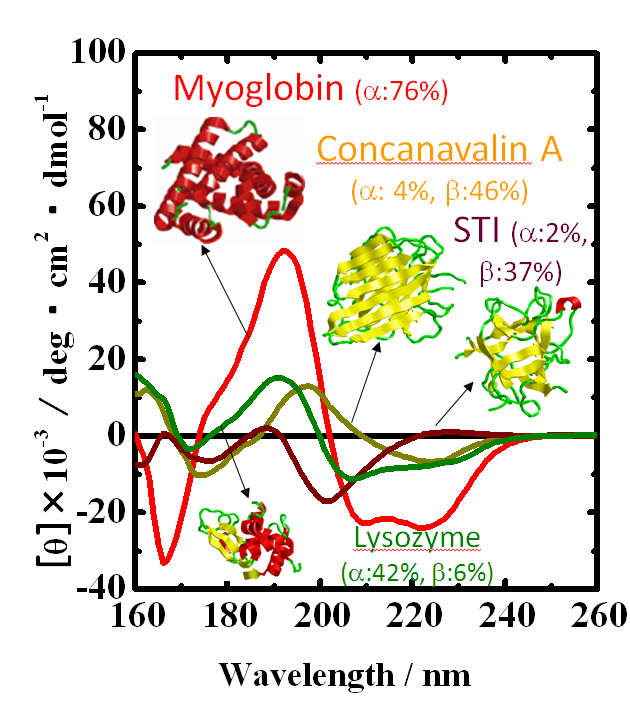
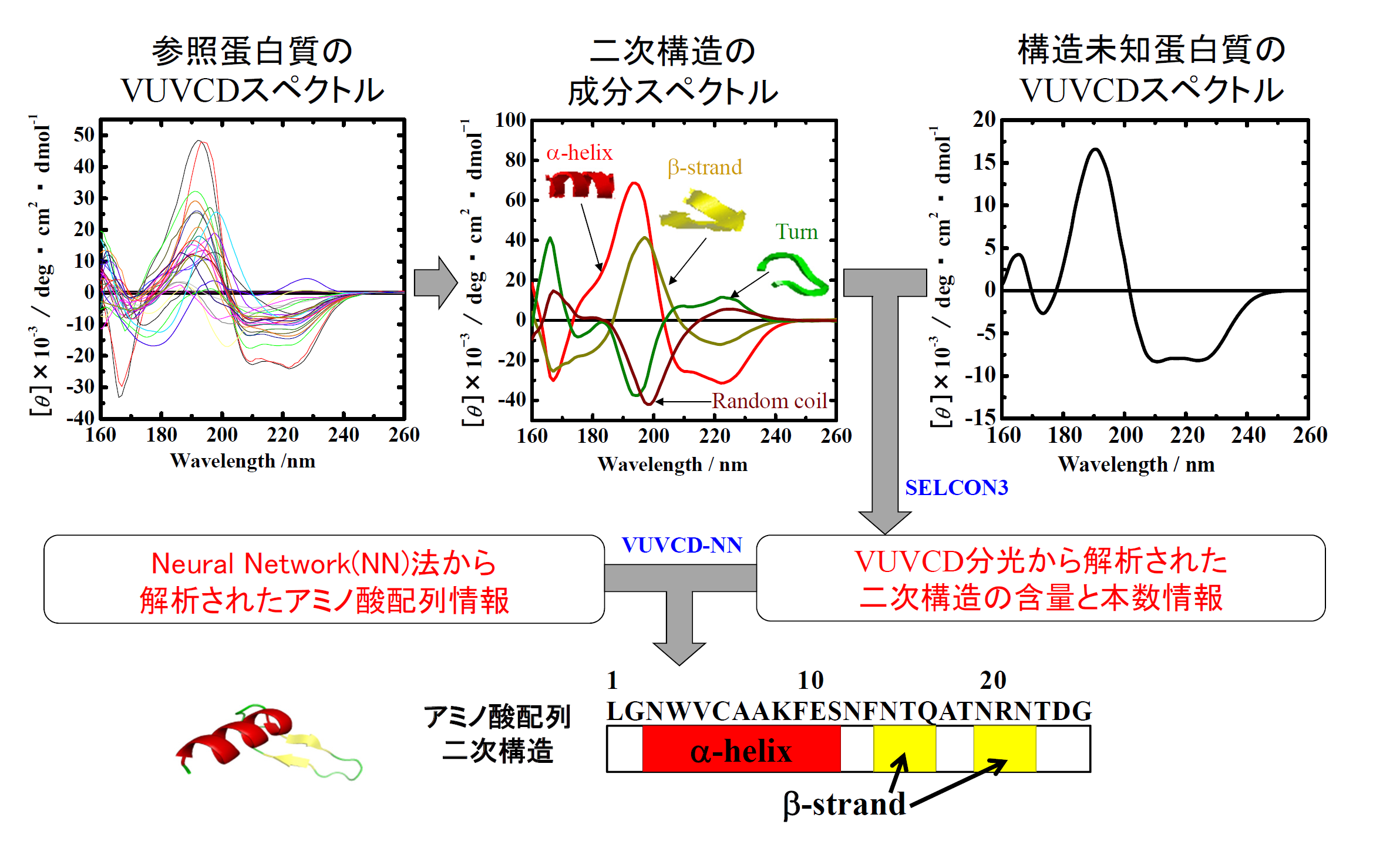
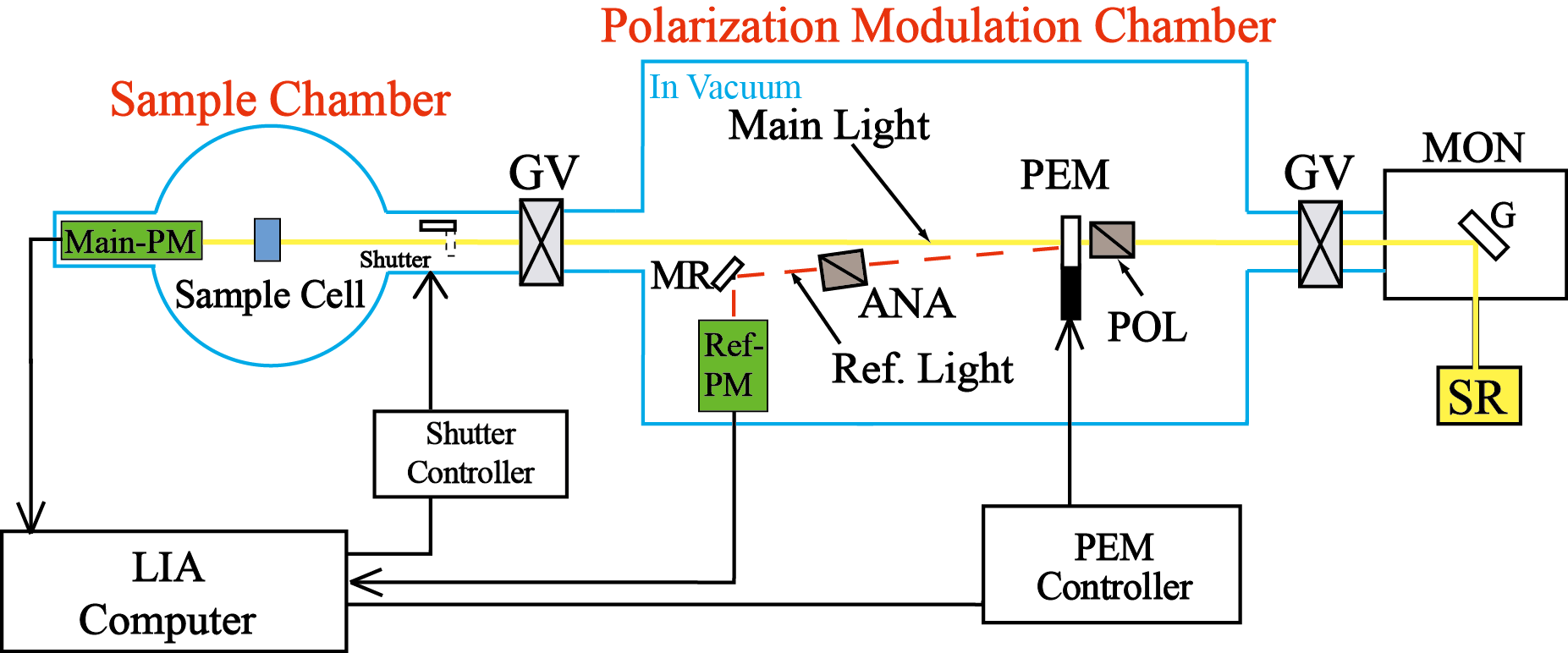
真空紫外円二色性分散計の写真を図1に、その模式図を図2に示す。すべての光学素子は、試料チェンバー(図1の左)と円偏光発生チェンバー(図1の右)内に設置されている。分光器(MON)により単色化された放射光(SR)は,直線偏光子(POL)により直線偏光に偏光された後,光弾性変調子(PEM)により50kHzの左右円偏光に変調される。その後,試料を設置している光学セル(Sample Cell)に照射され,フォトマル(Main-PM)により検知される。本装置には,直線偏光子で発生する異常光を参照光として検出する円偏光制御システム(光サーボリファレンス方式)が導入されている。この参照光により,ロックインアンプ(LIA)の安定性が向上し、またPEMの位相変調が精確に制御される。
 |
 |