|
|
|
|
|
|
研究内容 |
|
|
|
|
|
|
|
本研究室では、行動の重要な分子基盤となる細胞膜7回貫通型受容体(GPCR)の研究を行ってい
ます |
|
|
|
|
|
|
|
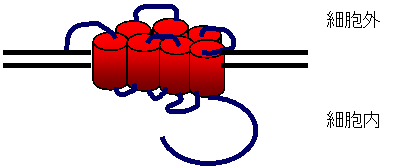
細
胞膜を7回貫通する構造の受容体にリガンドが結合すると、そのシグナルはGタンパ
ク質を介して細胞の内側へと伝達されます。このような受容体のことをGタンパク質共役型受容体 (G protein-coupled
receptor : GPCR)
と呼んでいます。GPCRの膜貫通部位はそれぞれのアイソログ間で良く保存されているため分子生物学的手法により新しいGPCRのシークエンスが比較的容
易であり、現在では、GPCRは線虫ゲノム全体では5.5%、ヒトゲノム全体では3-4%を占め、自然界に存在する大きなタンパク質ファミリーのうちのひ
とつを構成するまでに至っています。これまで哺乳類では約300のGPCR分子が同定されています(嗅覚受容体を含めると700を超える)。 |
|
|
|
|
|
|
|
こ
のうち約160はどのようなリガンドに結合するか判明していますが、残りの約
140は内因性リガンドが不明で、”孤児“(オーファン)受容体と名づけられています。一般に、膜タンパク質は疾患の標的分子となる比率が他の分子種に比
べて高く、この膜タンパク質のうちの多くがGPCRで占められています。実際にGPCRのアゴニスト・アンタゴニストは臨床の場で有効な実績を持つことが
示されています。すなわち、オーファンGPCRの内在性リガンドを探し出すことは生理活性物質を発見することであると同時に、新薬開発の新たな標的を探し
出す重要な研究テーマとなっています。 |
|
|
|
|
|
|
|
摂食・うつ・不安に関連するメラニン凝集ホルモン(MCH)とその受容体の研究
|
|
|
|
。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。
|
|
|
|
MCH
講座 |
|
|
① |
まず、「MCHとは何か?」 |
|
|
|
MCH
は川内先生が20年前にサケ脳下垂体から発見した皮膚体色変化に関係する神経ペプチドである。哺乳類においてMCHはラット脳から19個のペプチ
ドとして単離された。MCHは視床下部外則野の神経細胞体に局在し、MCH神経線維はペプチドニューロンとしては例外的に中枢神経系に広範囲に投射する。
1999年、その受容体は、私たちを含めた5つの独立した研究グループによりほぼ同時期に明らかとなった。それは内在性リガンドが不明だったG蛋白質共役
型受容体SLC-1そのものであり、(以後MCH1Rと呼ぶ)、薬理学的解析が初めて可能となった。MCH1R
mRNAは食行動および嗅記憶行動に非常に関連の深い脳部域で高発現している。また、扁桃体、外側中隔核や報酬系の中心である側坐核shellでも高発現
しているので、MCHシステムは快・不快情動発現や報酬行動においても重要な役割を持つことが予想された。 |
|
|
|
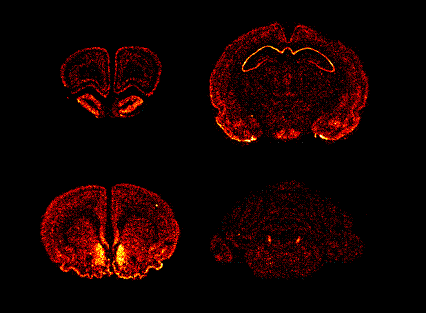 Brain distribution of MCH1R
mRNA in rat . Saito et al, 1999 Brain distribution of MCH1R
mRNA in rat . Saito et al, 1999 |
|
|
|
その後、MCH1RのサブタイプMCH2Rが報告され、ヒト・イヌ・アカゲザル等には機能的受容体が発現しているが、驚いたことにラット・マウス・ウサギ
等には存在しない。このため齧歯類での研究は行なえず、MCH2Rの機能解析には時間がかると思われる。 |
|
|
② |
次に「MCH系と摂食の深い関係」 |
|
|
|
MCH
の示す幾つかの生理作用のうち、特に注目を集めたのは摂食との関係である。MCHは機能的レプチンが欠損した遺伝的肥満モデルマウスob/obにお
いて過剰発現している。絶食によりMCH
mRNA発現量は上昇し、MCHを脳内投与すると摂食亢進を示す。更にMCHノックアウトマウスは摂食量が低下し、体重が減少する「ヤセ」形質を示した。
様々な摂食亢進性ペプチドの通常ノックアウトマウスにおいて摂食低下・体重減少を示したのは現在に至るまでMCH唯一つである。MCH系がエネルギー代謝
調節系において特異な位置を占めている証拠であろう。MCHシステムがより直接的に摂食調節及びエネルギー代謝へ関与する証拠は受容体(MCH1R)ノッ
クアウトマウスから推測できる。このマウスは予想に反して著明な過食を示すが、運動量が増加し基礎代謝率が亢進しているために体重が減少する。MCHがエ
ネルギー消費にも関わる証拠はレプチン欠損(ob/ob)/MCHダブルノックアウトマウスでも示唆されている。MCH1R選択性アンタゴニストの開発も
飛躍的に進展し、ラットへの経口投与によりMCH反応性の摂食を抑止したり、長期連続皮下投与により高カロリー食による肥満を抑制する効果が報告されてい
る。 |
|
|
③ |
そして
意外なことに「MCH系はうつ・不安にも関連する」 |
|
|
|
MCH1R
選択性アンタゴニストSNAP-7941の長期連続皮下投与は高カロリー食による肥満を予防した。しかし特に注目を浴びたのは「うつ・不安状
態」動物モデルを用いてSNAP-7941により抗うつ・抗不安作用が観察されたことである。当初はこの報告に対して疑問視する声もあったが、その後、他
のいつくかのMCH1Rアンタゴニストも抗うつ・抗不安作用を示した。逆にMCH1Rノックアウトマウスは抗うつ様症状を呈する。食事と精神状態は密接に
関係している。視床下部外側野から中枢神経系に向かって広く投射し、摂食調節系において非常に重要な位置に存在するMCH系がうつ・不安といった情動系と
深く関係していることは容易に想定できる。今後、様々なアンタゴニストの脳部位特異的な効果が判明し、摂食とうつに関係した視床下部への新規入力系が更に
明らかとなるかもしれない。 |
|
|
|
。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。。 |
|
|
|
そう、MCH系の研究は市場ニーズの高さから国内外の製薬企業を中心に非常に激しい競争の只中にあります。企業における研究は創薬を目指した
high-throughputアンタゴニストサーチ及びプロフェッショナルな行動薬理解析が中心です。一方、私達は脳神経系を中心としたMCH系に対す
るより深い理解を求める分子を中心とした生化学・分子生物学・薬理学・細胞生物学を用いた研究を行なっています。 |
|
|
|
MCH1RをHEK293T細胞やCHO細胞に強制発現させると、受容体はGi3、
そしてより弱い親和性でGqに共役し、アデニリルサイクラーゼ活性の抑制(サイクリックAMP産生の抑制)、フォスフォリパーゼCの活性化(細胞内カルシ
ウム濃度の上昇)、extracellular signal-regulated kinase
(ERK1/2)活性上昇を引き起こします。MCH1R内のどの位置にあるアミノ酸がどのような受容体機能に必須かという情報は3次元モデリングや創薬に
とって重要であり、ここ数年の間にその構造活性相関がin
silicoシュミレーションや様々な変異体作成を併用することにより次第に明らかとなってきています。これまでに、私たちはこれまで①細胞外にあるN-
グリコシレーション部位を同定し、その受容体膜輸送への寄与を証明、②受容体C末端はhelix8を形成することが予測され、情報伝達に重要な
dibasicモチーフが存在すること、③細胞内第2ループのArg155の持つ正電荷はG蛋白質と共役するために非常に大切であること、④GPCRにお
ける高度保存モチーフのMCH1Rにおける機能、⑤受容体インターナリゼーションに必要な部位の同定及びその制御シグナル分子について次々と報告してきま
した。更にMCH1Rに結合し、受容体の情報伝達機能を修飾する蛋白質についても生化学的手法で同定しています。 |
|
|
|
私たちの確立した多くのアッセイ系・ペプチド・抗体・60を越える変異体・受容体内
在性発現細胞・タンパク質精製の経験、そしてアメリカ時代に作り上げた信頼できる人脈から得る国際的情報網を最大限に生かし、今後もコンスタントに、そし
て信頼できる一味違った成果を発信していこうと思います。 |
|
|
|
具体的テーマとしては以下の3つとなります。 |
|
|
|
1. MCH受容体の構造活性相関解析の継続。特にスーパーアゴニスト感受性部位やG蛋白質選択
部位の解明。 |
|
|
|
2. 脳内特異的領域におけるMCH受容体を介した細胞内シグナル伝達の解析、及びMCH受容体
の機能を修飾する結合タンパク質の同定。 |
|
|
|
3. proMCHに存在するペプチド(NIE, NGI)の存在意義の解明。
|
|
|
|
今後は培養細胞レベルの受容体機能の調節に留まらず、MCH1Rを介する生理機能も制御する画期的な分子の同定を行いたいと思っています。
|
|
|
|
新しい生理活性物質の探索 |
|
|
|
新しい生理活性物質を、生理活性物質探索において伝統あるこの総合科学研究科で見つけたいと思っています。オーファン受容体探索の物理的精神的困難さは
やったことが1度でもある研究者ならわかりますが、それはそれはそれは物凄くしんどい!!”All or
None”なので非常にリスキーなプロジェクトで、若者の未来をノックアウトしてしまう可能性が高い! |
|
|
|
そして今までのようなFLIPRと293T細胞を用いたストラテジーで取るのは難し
いことは、最近のオーファンリガンド発見が激変していることから明らかです。それをクリアするためには画期的な新しい系が必要、そこで淡々と策を練って予
備実験中です。他の総合科学部の研究室との有機的研究体制で臨めば何かできる!はず、、、、、。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

 Brain distribution of MCH1R
mRNA in rat . Saito et al, 1999
Brain distribution of MCH1R
mRNA in rat . Saito et al, 1999