研究内容
当講座では、「小胞体ストレスと疾患」をキーワードに研究プロジェクトを進めています。
虚血、酸化ストレス、感染などの様々な異常環境に曝されると、小胞体の働きに破綻を来たし、不完全なタンパク質が小胞体に大量に生み出されます(小胞体ストレス)。細胞はこの様な異常事態を感知する小胞体ストレスセンサーを有しており、異常タンパク質の修復や分解を行うシステムを積極的に駆動させて細胞傷害から身を守ります(小胞体ストレス応答)。恒常的な小胞体機能異常は、癌、糖尿病などの代謝性疾患、神経系疾患、動脈硬化性疾患などの発症にも直結します。最近、これら疾患の鍵となる現象、すなわち細胞増殖、血管新生、サイトカインによる炎症反応の増強などに小胞体ストレス応答が関与する可能性が指摘されています。当研究室では、これまで小胞体機能障害から起こる細胞死のメカニズムや各種疾患の発症と小胞体ストレスとの関連性について明らかにしてきました。また新規の小胞体ストレスセンサーの同定に成功し、それらが様々な臓器・組織でみられるストレス応答や機能調節に関わることを明らかにしてきました。このような研究成果を基盤にして、小胞体ストレス応答シグナルネットワークを起点とする生体制御やその破綻による慢性炎症性反応を分子レベルで詳細に解明するとともに、そのネットワークを自由にコントロールすることで各種難治性疾患の新たな治療戦略構築を目指しています。
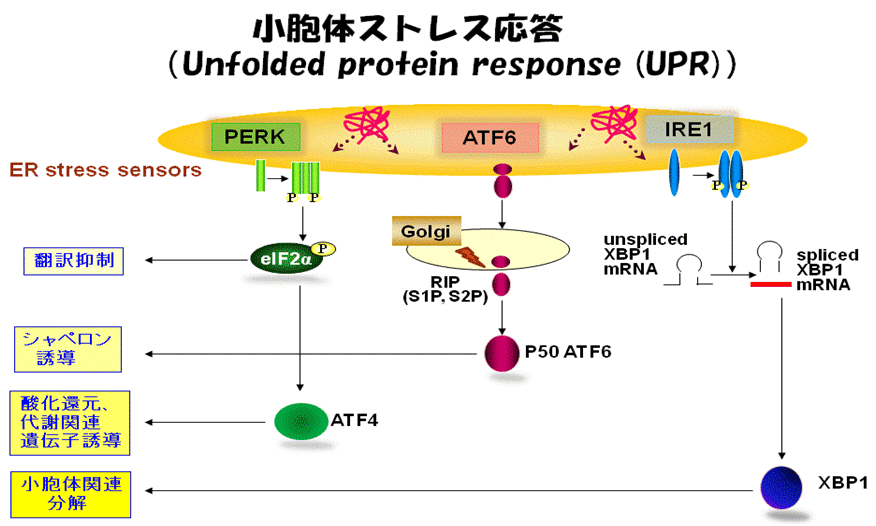
図1.小胞体ストレス応答に関わる分子とシグナル伝達
1.新規小胞体ストレスセンサーの発見
当教室では、小胞体ストレスセンサーのATF6に構造的に類似した小胞体に局在する膜貫通型転写因子群を発見した(図2)。これらは共通してN末端側に遺伝子転写活性化ドメインとDNA結合に重要なbZIPドメインを、C末端側には膜貫通領域と小胞体内腔ドメインを有する。OASISやBBF2H7は小胞体ストレスを負荷すると膜内切断を受けて、断片された細胞質側のN末端断片は核内に移動する。核内ではCRE(cyclic-AMP response element)配列に結合してターゲット遺伝子を誘導する。
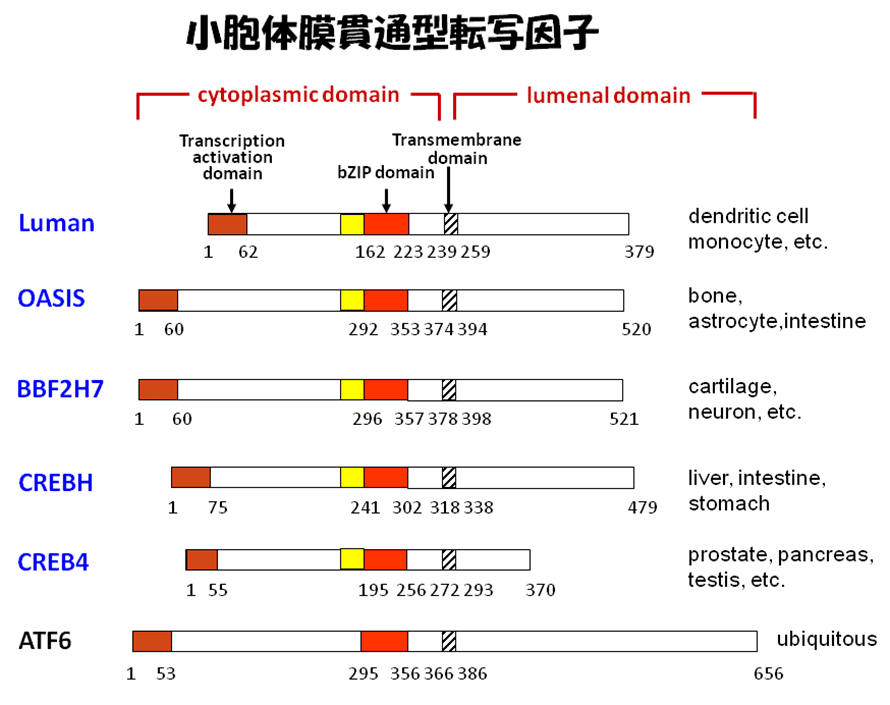
図2.ファミリーの構造的特徴(A)と活性化機序(B)
Kondo, et al., Nature Cell Biology, 2005
Kondo, et al., Molecular Cellular Biology, 2007
Asada, et al. Journal of Biochemistry, 2011
2.小胞体ストレスと生体制御
当研究室で見出した新規小胞体ストレスセンサーOASISとBBF2H7の生体内機能について解析を進めている。
1)小胞体ストレスセンサーOASISは骨形成に必須である
OASISを欠損したマウスを作成すると、身体が小さく大腿骨や踵(かかと)にしばしば骨折がみられた。全身の骨を細かく顕微鏡で調べたところ、骨量の著しい減少を伴う骨形成不全症であることがわかった(図3)。
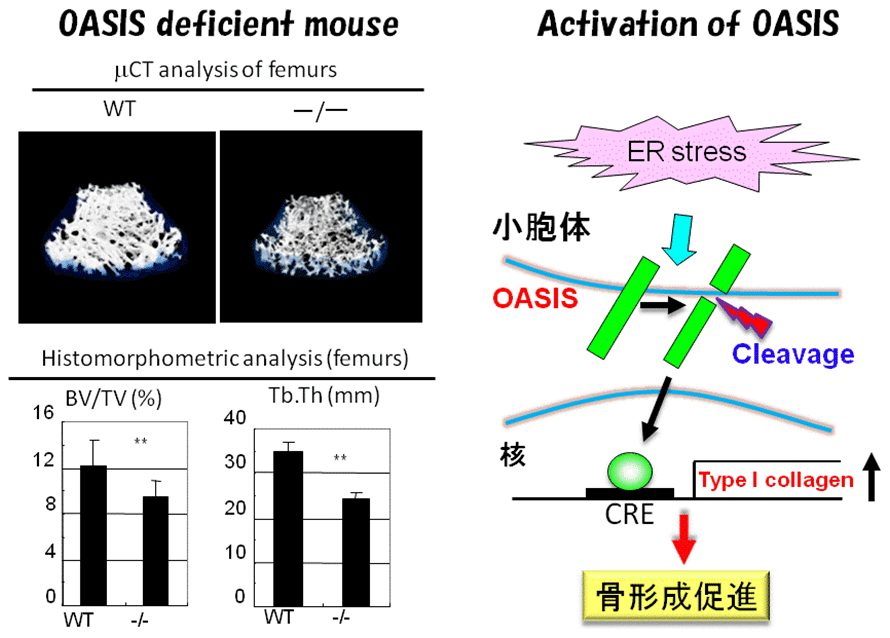
図3.OASISノックアウトマウスとOASISの機能
Murakami, et al., Nature Cell Biology, 2009
OASISの欠損により何故骨の形成に障害を来したのかを調べたところ、OASISは骨の主要な構成タンパク質である1型コラーゲンを作る役割があることがわかり、OASISがなくなることで1型コラーゲンの産生が低下し、骨量の減少を招いたと考えられた。OASIS自体は骨を作りだす骨芽細胞の小胞体に存在する。OASISを欠損したマウスでは骨のタンパク質成分が骨芽細胞の小胞体にとどまり、細胞の外に分泌されない。コラーゲンの産生低下と骨基質タンパク質の分泌障害が骨形成不全の原因であることがわかった。
2)小胞体ストレスセンサーBBF2H7は軟骨細胞の分化とマトリックス分泌に関わる
BBF2H7を欠損したマウスは軟骨組織をうまく作れず、骨格の低形成を示した。このマウスの軟骨細胞では軟骨基質タンパク質が細胞の外に分泌されず、細胞の小胞体内に蓄積していた。何故小胞体が拡張したのかを詳しく調べたところ、BBF2H7には、輸送小胞の形成に必須のタンパク質であるSec23aの合成を促進する働きがあることがわかった。すなわち、BBF2H7が欠損したことでSec23aが極度に減少し、本来は細胞の外に分泌される軟骨基質タンパク質が小胞体内に留まり続けたことが、軟骨組織の形成障害につながったと考えられる。本研究成果は小胞体の機能が軟骨組織の形成に重要な役割を担っていることを初めて示したものである。
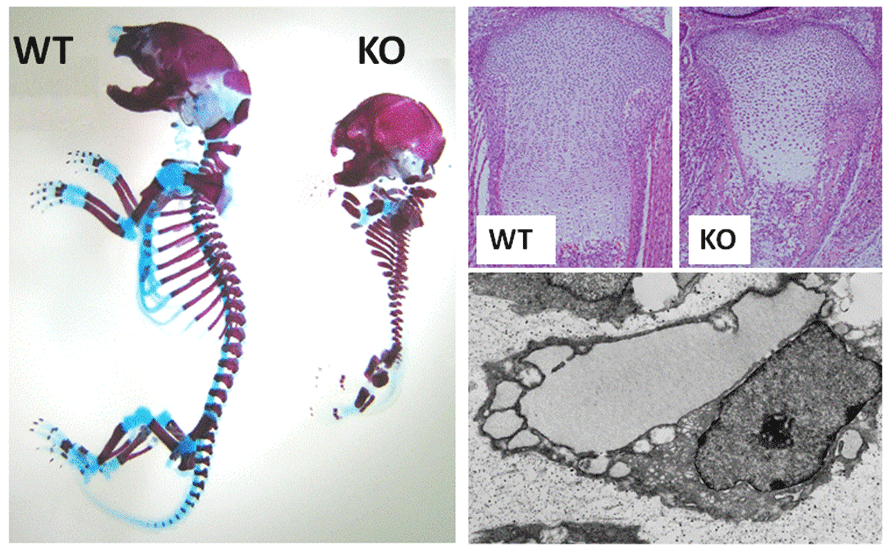
図4.BBF2H7の遺伝子欠損マウス
左;アルシアンブルー・アリザリンレッド染色。軟骨(水色)形成不全を起こす。
右上;ヘマトキシリン・エオジン染色。増殖軟骨層の細胞数が減少し、マトリックス形成が低下している。
右下;ノックアウトマウスの軟骨細胞の電子顕微鏡写真。分泌基質を貯め込んだ粗面小胞体が異常に拡張している。
Saito, et al., Nature Cell Biology, 2009
生理的小胞体ストレス応答physiological ER stress response
小胞体ストレス応答は、小胞体に蓄積した異常タンパク質を排除し細胞傷害から保護するストレス防御システムと考えられてきた。しかし、OASISやBBF2H7の解析から明らかになったように、小胞体ストレスセンサーからのシグナルは、ストレス回避の働きではなく、細胞の分化や成熟、細胞増殖あるいは組織形成等に重要な働きをすることがわかった(Murakami et al., Nature Cell Biol., 2009, Saito et al., Nature Cell Biol., 2009, Saito et al., Nature Commns., 2012)。
3.小胞体ストレスと慢性炎症に関する研究
炎症反応を引き起こす細胞ストレスは小胞体の秩序撹乱(小胞体ストレス)を起こす。細胞はストレスに応答して小胞体からシグナルを発信(小胞体ストレス応答)して細胞機能を変化させる。機能変調した細胞は、周囲細胞との相互作用を介して不可逆的な組織のリモデリングを誘発し炎症を慢性化・遷延化すると考えられる。当研究室では、細胞の増殖、血管新生、サイトカイン分泌といった慢性炎症応答に関わる各事象の分子機構に焦点をあて、慢性炎症における小胞体ストレス応答の解析を進めている。このような研究を通して、小胞体ストレス応答を制御することで、慢性炎症を契機として生じる癌、網膜疾患、糖尿病等に対する治療戦略の開発を目指している。
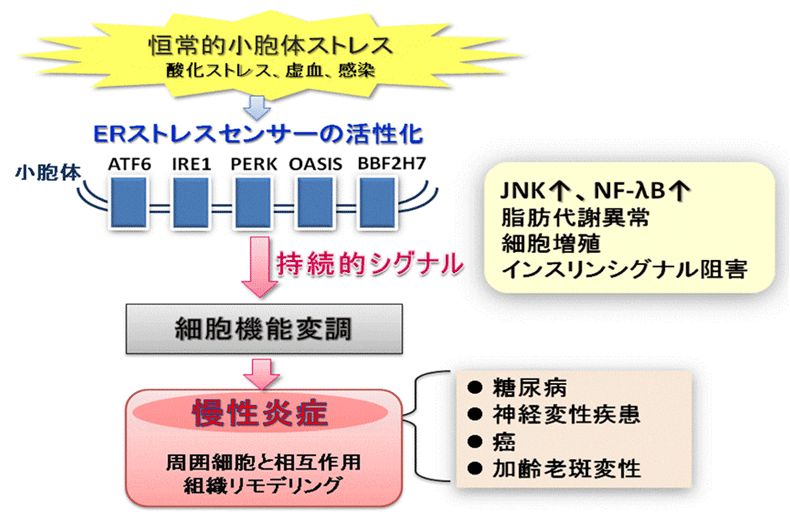
図5.慢性炎症と小胞体ストレス応答
小胞体ストレスセンサーは恒常的な小胞体ストレスに応答して活性化し、持続的にシグナルを発信し続ける。
その結果、細胞の機能変調が起こり、周囲細胞との相互作用を通して組織のリモデリングを誘発する。
このような小胞体ストレス応答によって慢性炎症が誘発され、様々な疾患を引き起こす。
