動物の発生において、個々の遺伝子を時空間的に適切に発現させることはとても重要です。このような時空間的な遺伝子発現制御は、転写因子による転写活性化・抑制だけでなく、DNAのメチル化やヒストンの化学修飾によっても制御されています。また、発生の初期には卵割という速い細胞周期の細胞分裂が行われるほか、核のサイズ・ヌクレオソームのポジショニング・ヒストンバリアントの型・DNAメチル化・ヒストン修飾などの変化が観察されます。このような激しい環境変化の中、遺伝子はどのように適切に発現制御を受けるのでしょうか。
染色体動態
間期の核において、ここの染色体は別々の領域を占有し染色体テリトリーを形成しています。核の構造と遺伝子発現との間には密接な関係があり、遺伝子の多い染色体は核の内側に、遺伝子の少ない染色体は核の周辺部に局在する傾向があります。核の周辺部の環境が遺伝子発現に対して抑制的であるという傾向があるようですが、活発な転写が核の周辺部で起こるという例もあります。また、転写の活性化にともなって核周辺部の不活性な遺伝子が核の内側に移動するという報告もあるし、核膜孔複合体と相互作用するという報告もあります。
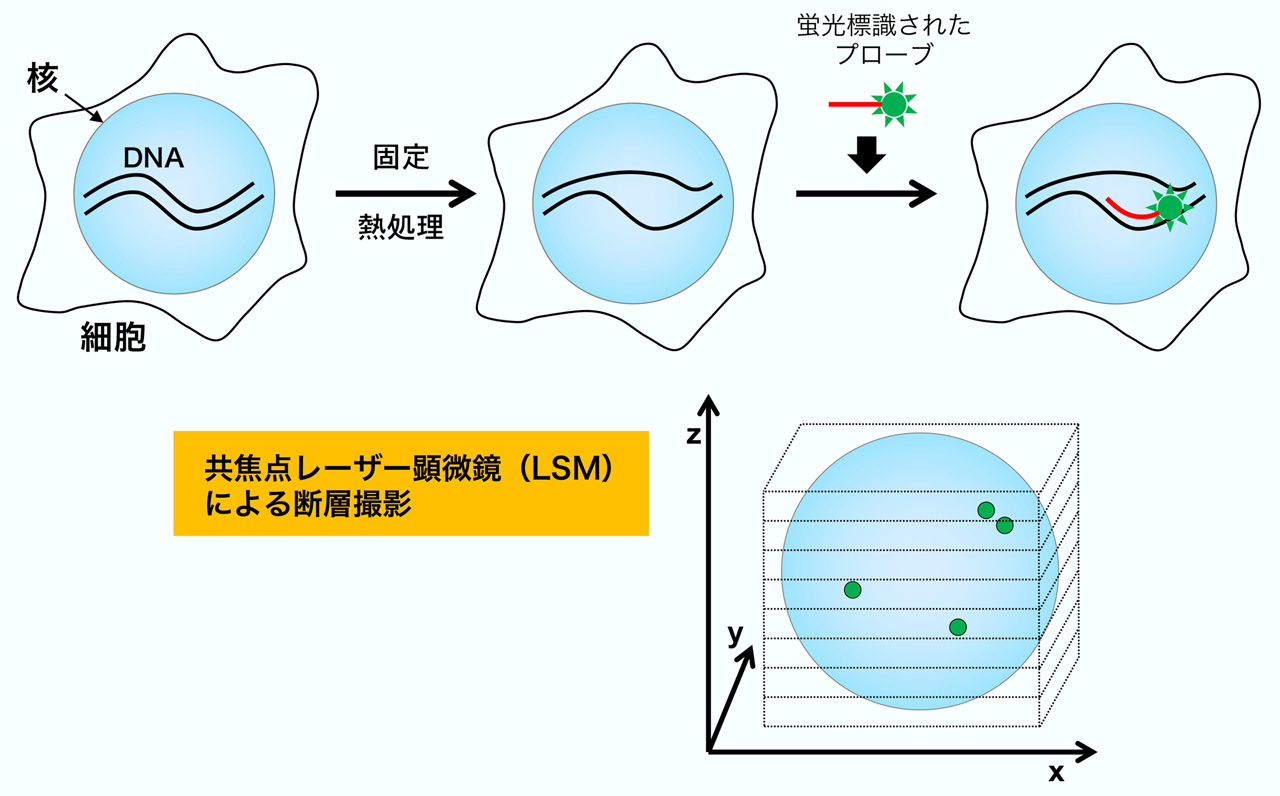
私たちは、ウニの初期発生における核内での遺伝子や染色体の動態を解析しました。用いた手法は、3次元蛍光in ituハイブリダイゼーション(3D-FISH)という方法です。この方法では、まずウニ胚をホルムアルデヒドで固定します。これを熱処理して二本鎖のゲノムDNAを変性させたのち、蛍光標識されたプローブを用いてハイブリダーゼーションを行います。蛍光プローブは相補的な配列をもつ特異的なDNA領域に結合するため、共焦点レーザー顕微鏡を用いて核を断層撮影して核内における蛍光シグナルの位置を3次元的に解析すれば、目的の遺伝子の核内における位置を解析できるのです。
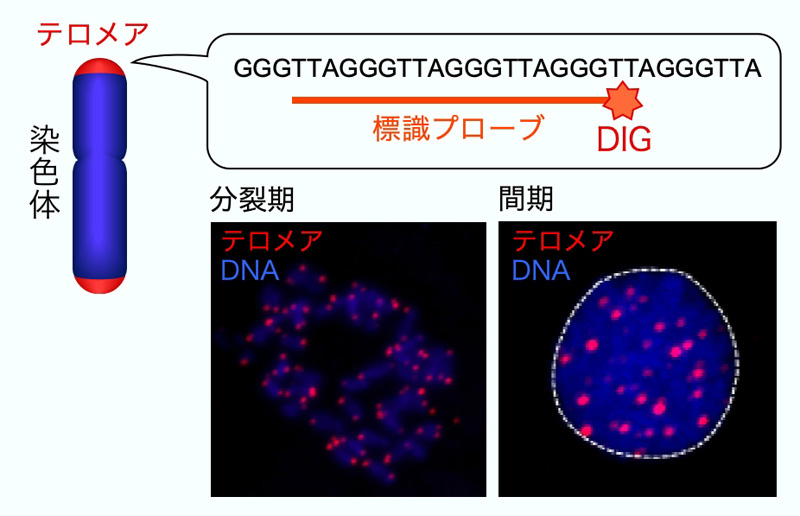
まず手始めに、染色体の末端部であるテロメアの解析をしました。酵母やショウジョウバエなどでは、全染色体のセントロメアが核周辺部の一部に集中して局在し、テロメアがその反対側の周辺部に局在するRabl配向をとることが知られています。そこで、テロメア配列(TTAGGGの反復配列)に相補的な標識プローブを作製して3D-FISHを行ったところ、ウニのテロメアは哺乳類のテロメアと同様、分裂期には染色体の末端部に、間期の核では核全体にランダムに分布することがわかりました。
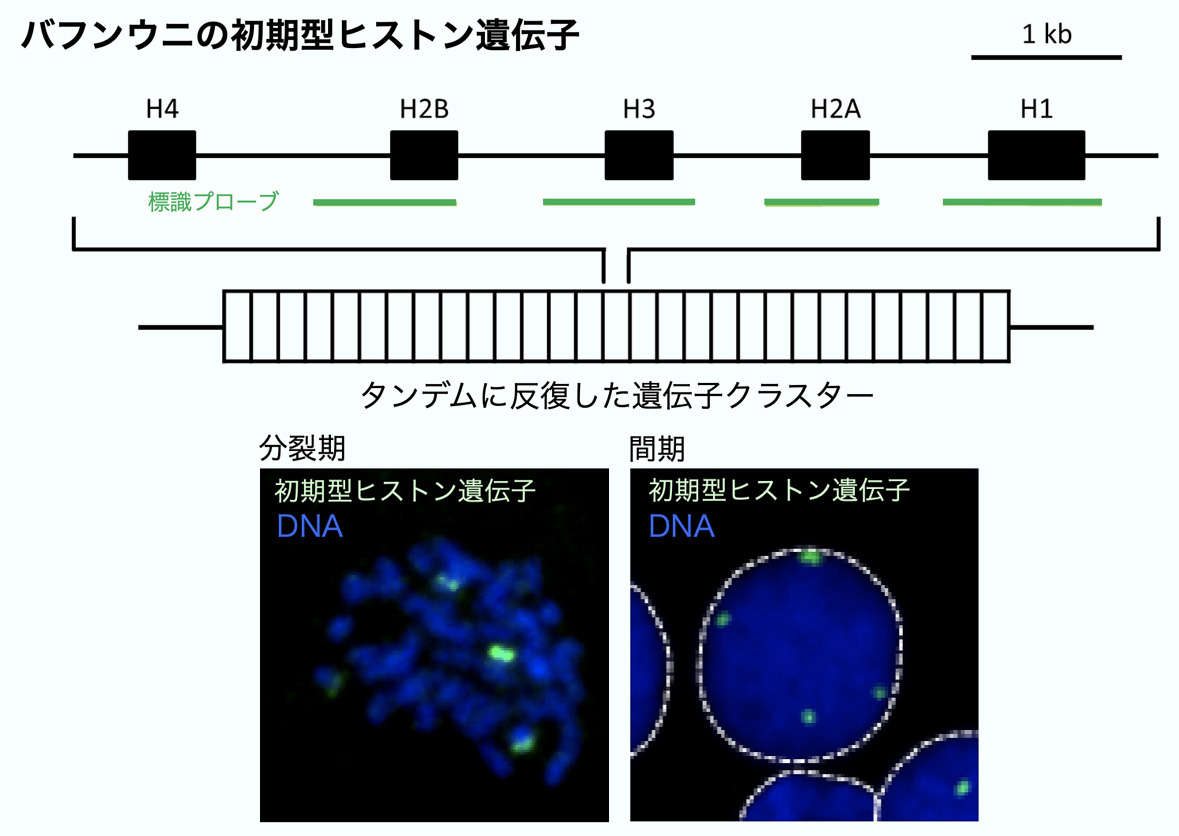
次に、初期型ヒストン遺伝子座の核内配置を3D-FISHにより解析しました。初期型ヒストン遺伝子はヒストンH4, H2B, H3, H2A, H1遺伝子のセットがタンデムに数百コピー反復した構造をしており、その発現は受精後に上昇し始めて桑実胚でピークに達し、その後減少して原腸胚期までに消失します。このヒストン遺伝子に対する標識プローブを作製して3D-FISHを行ったところ、分裂期には4箇所(4ペア)で蛍光シグナルが検出されました。つまり、この遺伝子座はゲノムあたり2箇所存在することになります(二倍体細胞だから合計4箇所になる)。そして、間期の核でも4スポットの蛍光シグナルが検出されました。
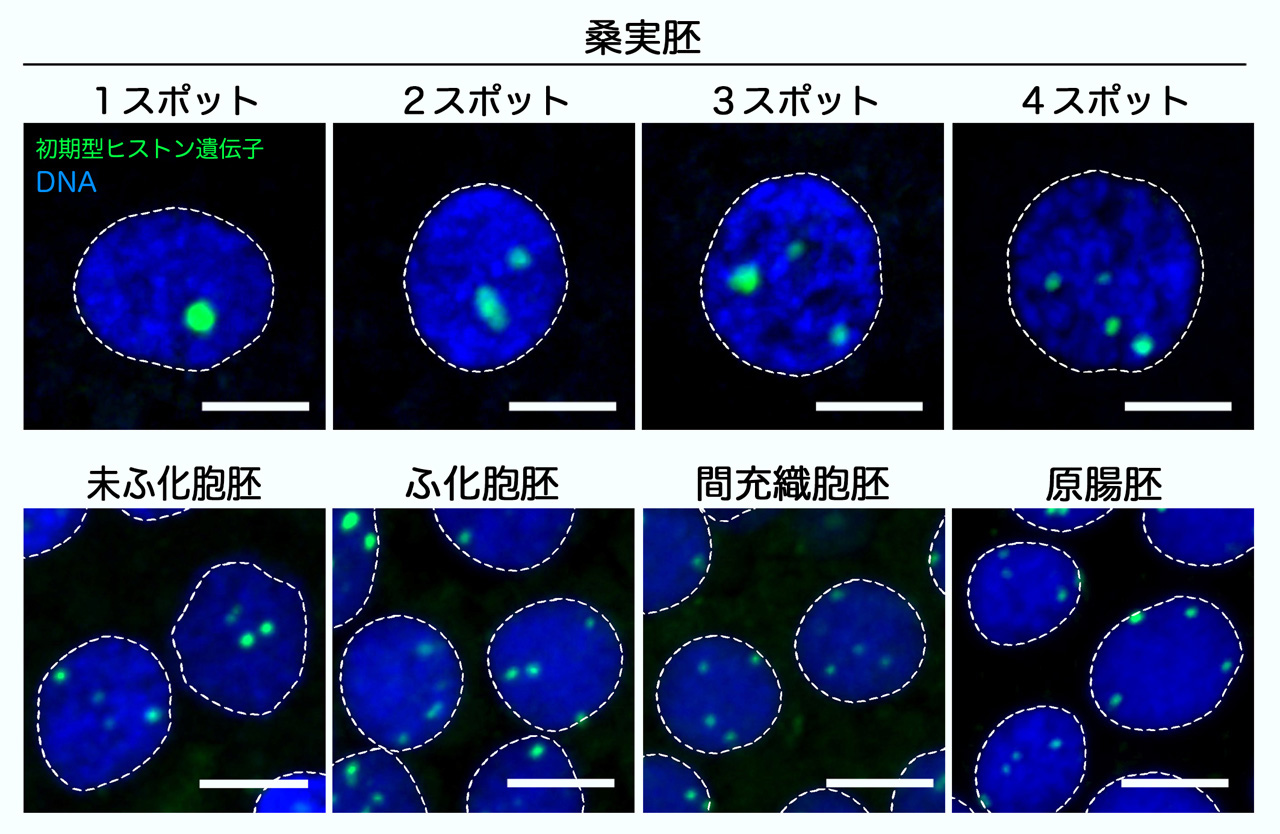
さらに発生段階を追って解析したところ、初期型ヒストン遺伝子の発現が活発な桑実胚では1〜4スポットの蛍光シグナルが検出されました。この1〜3スポットの蛍光シグナルは、染色体間(遺伝子座間)の物理的な相互作用を示していると考えられます。そして、桑実胚では1〜3スポットの蛍光シグナルを示す核が最も多く、発現が消失する原腸胚では4スポットのシグナルを示す核が最も多くなりました。さらに、桑実胚では蛍光スポットが核のより内側に位置する傾向があることも明らかになりました。このような遺伝子座の核内配置の意義や分子メカニズムについて、ウニの発生をモデルに研究しています。