Zinc-finger nuclease (ZFN)
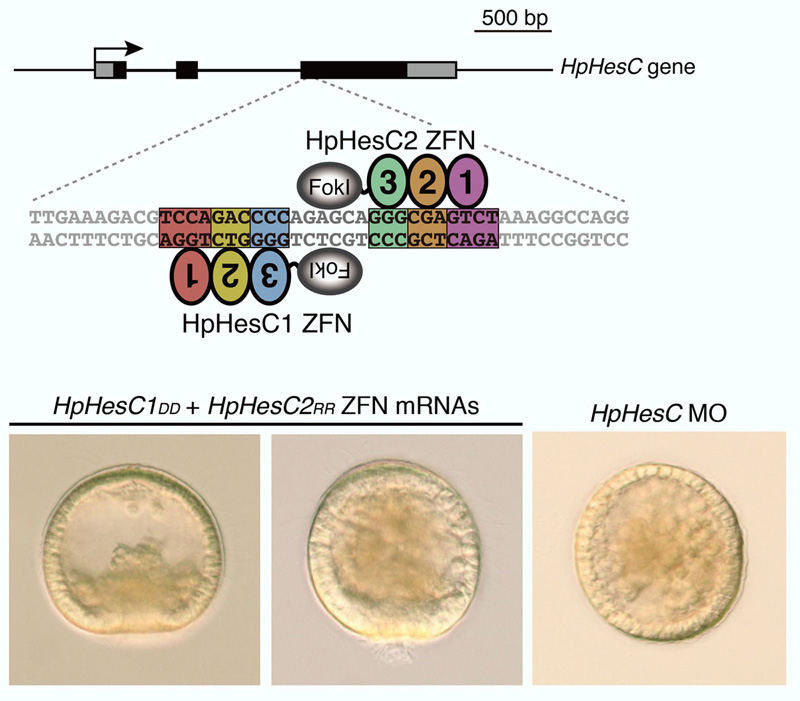
2010年に当研究室から、ウニで最初のゲノム編集が報告されました。Zinc-finger nucleaseを使って、小割球以外の領域でEtsなどの制御因子の発現を抑制する機能をもつHesC遺伝子を標的としました。HesC ZFN mRNAをウニの受精卵に顕微注入したところ、約10%のZFN mRNA導入胚において一次間充織細胞数の増加が観察されました。ZFN mRNAの導入によるフレームシフト変異率は44%で、受精後4時間までに変異の導入が始まり、受精後12時間で最大レベルに達することがわかりました。
Ochiai et al., Targeted mutagenesis in the sea urchin embryo using zinc-finger nucleases. Genes to Cells 15(8), 875-885 (2010). doi: 10.1111/j.1365-2443.2010.01425.x.
Transcription Activator-Like Effector Nuclease (TALEN)
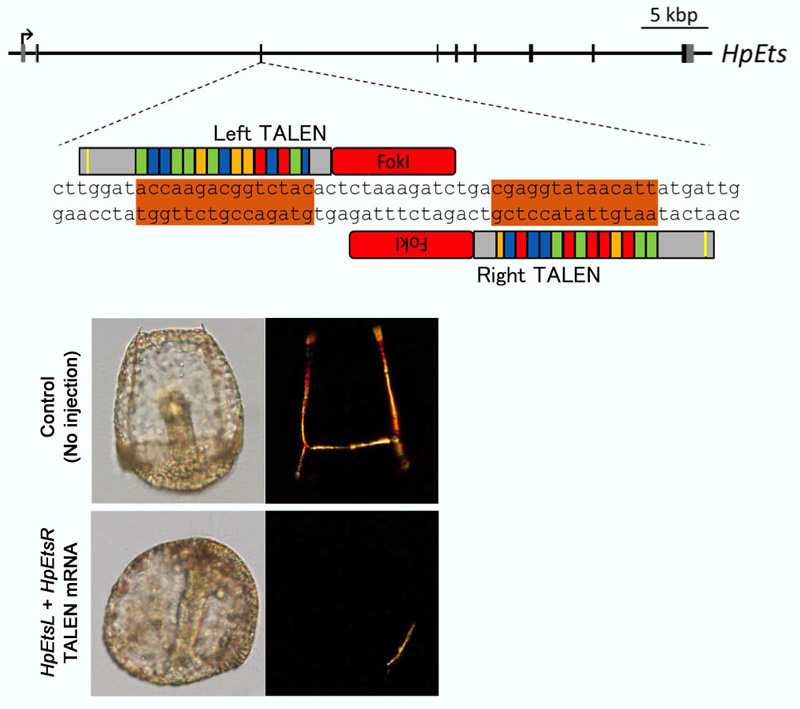
2014年には、ウニ胚で一次間充織細胞の特異化に必須なEts遺伝子を標的とした、高活性型のPlatinum TALENによるノックアウトが報告されました。Ets遺伝子を標的としたTALEN mRNAをウニ受精卵に顕微注入したところ、12.6%の胚で骨片の形成不全が観察されました。また、受精後24時間で51.9%のEts遺伝子にフレームシフト変異が導入されていることも示されました。
Hosoi et al., Targeted mutagenesis in sea urchin embryos using TALENs. Development, Growth and Differentiation 56(1), 92-97 (2014). doi: 10.1111/dgd.12099.
CRISPR-Cas9システム
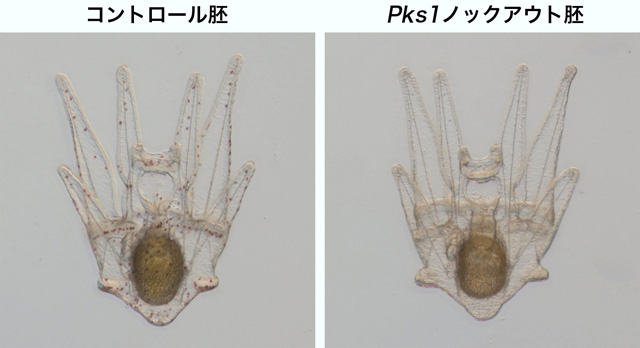
2019年には、バフンウニでのCRISPR-Cas9システムによるゲノム編集が報告されました。バフンウニの幼生の色素合成に重要なポリケチド合成酵素をコードするPks1遺伝子を標的とするガイドRNA (sgRNA)とCas9 mRNAをウニ受精卵に顕微注入したところ、Pks1遺伝子への変異導入が確認され、色素をもたないアルビノのプルテウス幼生ができました。しかも、使用したsgRNAの1つは変異導入効率が100%であり、すべてのノックアウト胚が色素をもたないアルビノ表現型を示すプルテウス幼生へと発生しました。
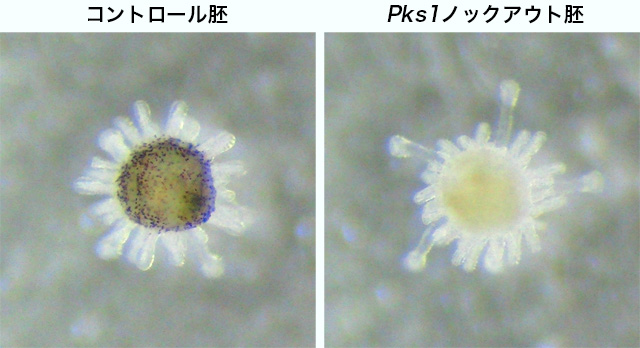
さらにその後、アルビノのプルテウス幼生は正常に成体原基を形成し、変態を経て色素をもたない稚ウニへと成長しました。そして、その後1年以上研究室内の水槽で生育し、真っ白なアルビノの成体ウニになりました。





