ポリリン酸
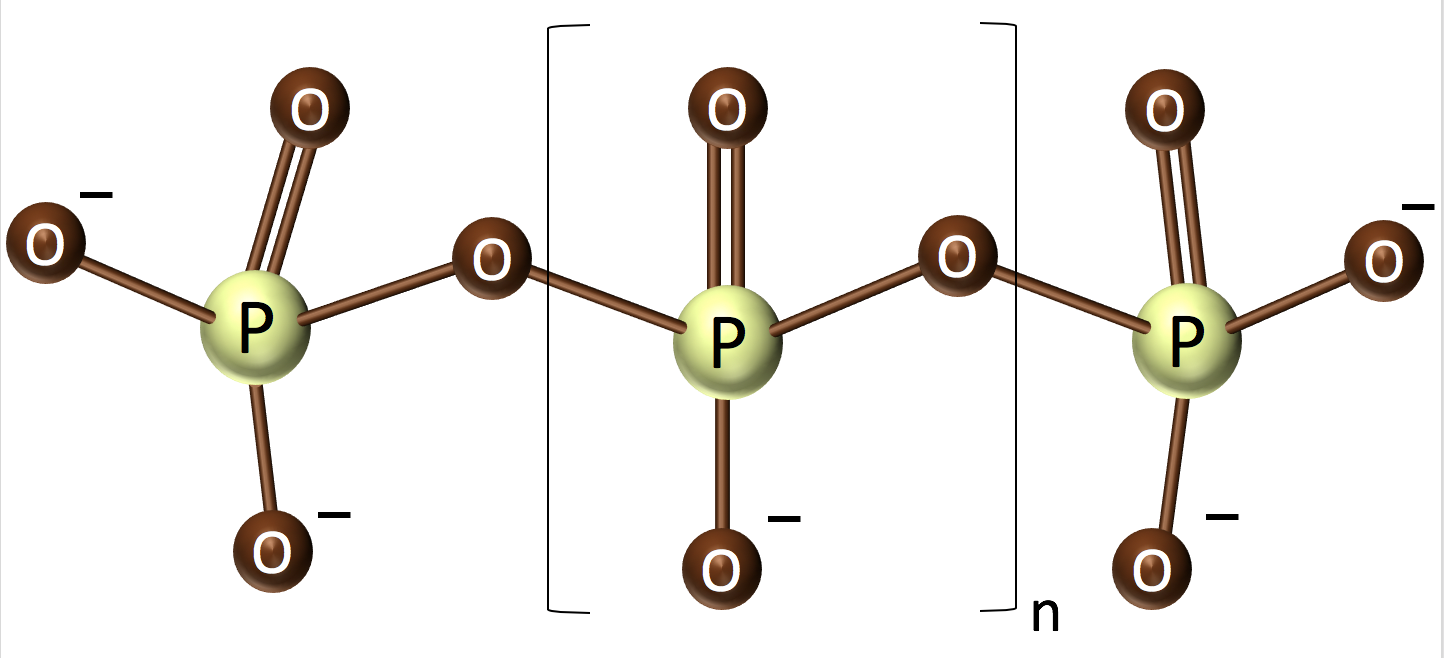
ポリリン酸は、無機リン酸が高エネルギーリン酸結合でつながったポリマーである。リン酸ナトリウムなどを単に数百℃で加熱するだけで縮合して合成されることから、原始地球環境で比較的豊富に供給された太古の生命エネルギーと考えられている。
生物はポリリン酸合成酵素(PPK)によってポリリン酸を合成する(ATP + polyP n ⇄ ADP + polyP n+1)。nは長い場合700個になる。アーサーコーンバーグ博士らによって発見されたPPKは、逆反応によってATPを合成する。また、ある種の微生物はポリリン酸を直接物質のリン酸化に利用する酵素を持つ。ポリリン酸は生命のエネルギー物質である以外に、リン酸の塊でもあるので、リンの貯蔵という意味も持つ。
キーワード:ポリリン酸、ATP、リンの貯蔵、エネルギーの貯蔵、代謝制御
少しロマンのある話
ポリリン酸をマグネシウムイオン存在下で加熱すると、環状の3リン酸であるトリメタリン酸が生じる。そのトリメタリン酸とアデノシンを混合すると、無生物的にATPができる(酵素不要)。生物がなぜ3つのリン酸が重合したATPを生命エネルギーとして選んだかはわからないが、ひょっとすると、ポリリン酸からのATP合成に理由があるのかもしれない。
ポリリン酸の生命機能
ポリリン酸の生命機能には、主に(1)リンの貯蔵、(2)エネルギーの貯蔵、(3)代謝制御の機能があると考えらる。ポリリン酸の生命機能は混沌としているが、生物によってそれぞれの使い方があるのだろうと思う。個人的な直感を含めて整理したい。
(1)リンの貯蔵:おそらく酵母は典型だと思われる。酵母では、ポリリン酸合成の逆反応によるATP合成はほとんど起こらない(エネルギー貯蔵の意味はない)。また、蓄積する場所も液胞にほぼ限られる。リンに飢餓になると、ポリリン酸が無くなることから、酵母でのポリリン酸の役割はリンの貯蔵と言っていい。
(2)エネルギーの貯蔵:ある種の微生物は、嫌気条件下でポリリン酸を分解し、有機物を取り込んで、ポリマー(ポリヒドロキシブチレート等)にする。その際、ポリリン酸は酢酸からアセチルCoAの合成に必要なエネルギーを供給しいる。もう少し詳しく言うと、ATP→AMP+ピロリン酸のエネルギーを使ってアセチルCoAの合成し、AMP→ATPの再生にポリリン酸が使われている。この微生物は、未だ単離できない微生物だが、近年ゲノムが解読された結果、PPK2というポリリン酸のエネルギーを引き出す酵素が5種類も持っていることが分かった。我々は、PPK2の中に、ポリリン酸とAMPからATPを作るもの新しく発見した。微生物には、このPPK2を持っているものと、持っていないものがあることが分かっている。ゲノムの中のPPK2の数が、ポリリン酸のエネルギーとしての役割の程度を示す指標と考えている(直感)。おそらく、このPPK2を持っていないものは、エネルギー貯蔵という役割が少ないか、ほとんどないと思われる。
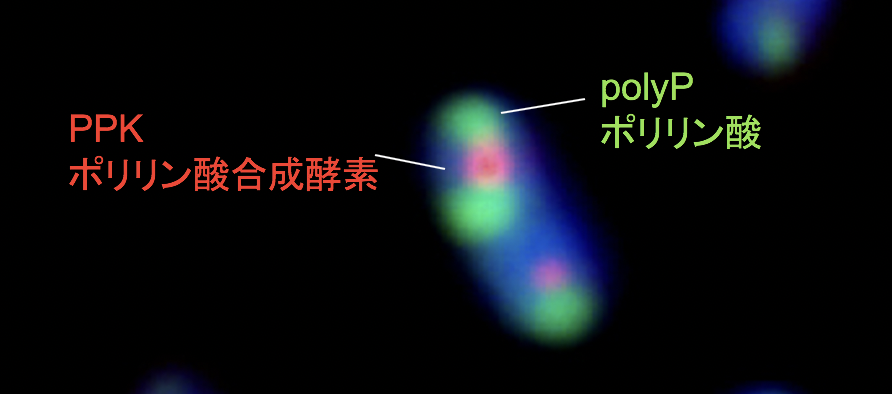
(3) 代謝制御の機能:大腸菌はこのPPK2を持っていない代表格であるが、微生物界全体からするとマイナーである。野生型の大腸菌では、ポリリン酸を蓄積したとしても、前述の2つに較べてはるかに低い含量でしかない。これでは、リンの貯蔵、エネルギーの貯蔵の意味は低い。一方、大腸菌はアミノ酸飢餓でポリリン酸を蓄積することがわかった。なぜアミノ酸飢餓でポリリン酸が蓄積するのか、という疑問からポリリン酸によるプロテアーゼ(Lon protease)の活性化機構を発見した。
論文
A. Kuroda, et al., Science, 293, 705-708 (2001).
野村 和孝、大竹 久夫、黒田 章夫、Lonによるリボソーム蛋白質のリサイクリングシステム
蛋白質核酸酵素 49, 1069-1070 (2004)
リン蓄積菌の開発
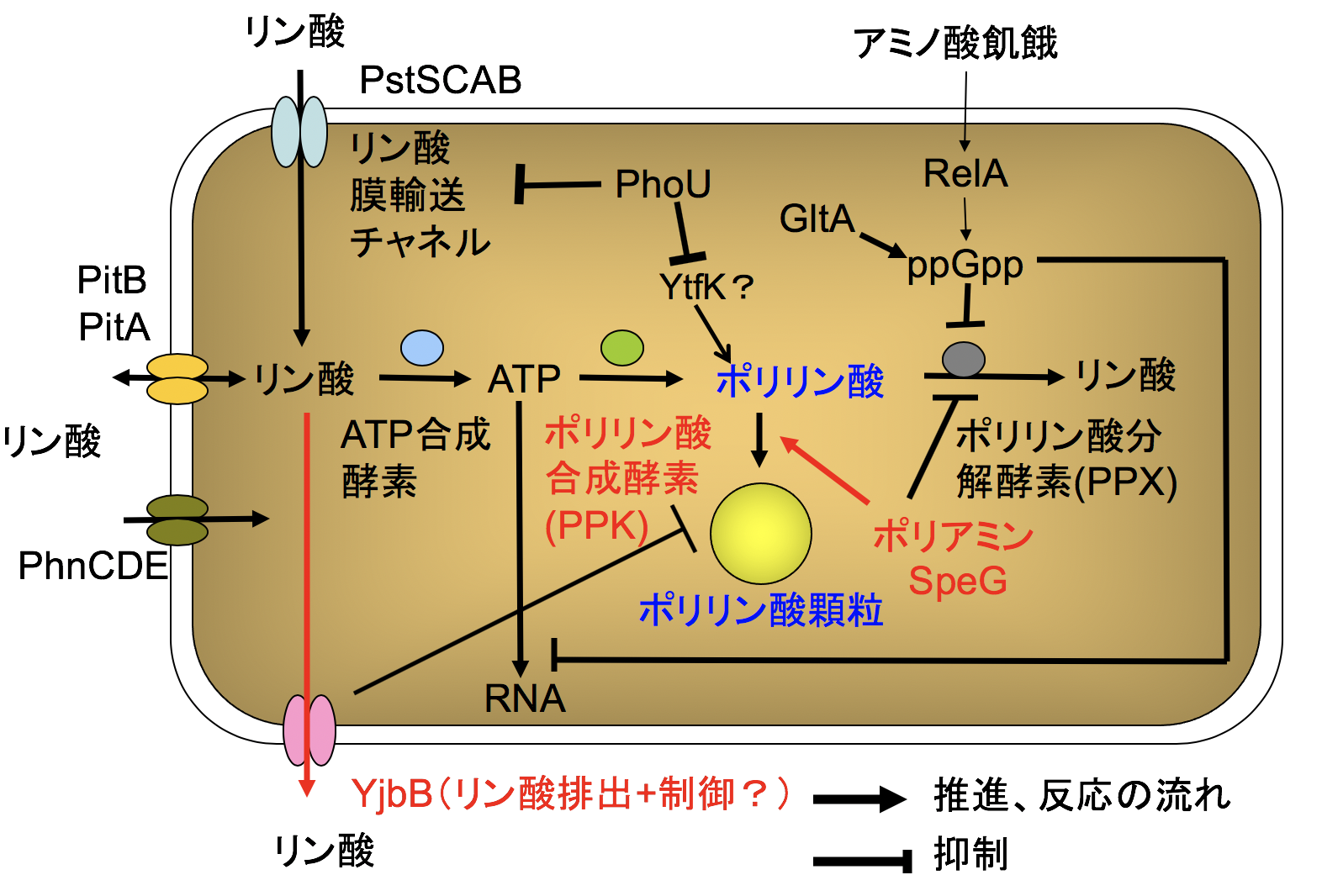
リンは食料生産に必須の元素であるが、有限の資源であるリン鉱石から供給されている。日本は100%輸入に依存しており、将来食料生産にとって最も憂うべき資源となる可能性が高い。排水からリンを回収する技術は重要な意味を持つ。
リン酸輸送体タンパク質PstSCABとポリリン酸合成酵素遺伝子PPKを高発現させた大腸菌は多量のポリリン酸を蓄積し、菌体のリン含量は最大で乾燥菌体重量の16%にも達した(リン鉱石の平均は10%)。
また、変異剤を使ってポリリン酸蓄積変異株の取得も可能である。PhoUが変異すればリン酸十分条件下でもPstSCABが恒常的に発現し、リン酸を取り込み続けてポリリン酸が蓄積する。この方法を用いれば、活性汚泥から単離された微生物をリン蓄積菌に変えることが可能である。
論文
J. Kato et al., Appl. Environ. Microbiol., 59, 3744-3749 (1993)
T. Morohoshi et al., Appl. Environ. Microbiol., 68, 4107–4110 (2002)
ポリリン酸を使ったもの作り
ATPを利用する酵素には工業的に重要な反応を触媒ものがある。酵素を使ったもの作りにおいて、エネルギーを如何に供給するかが問題となる場合がある。
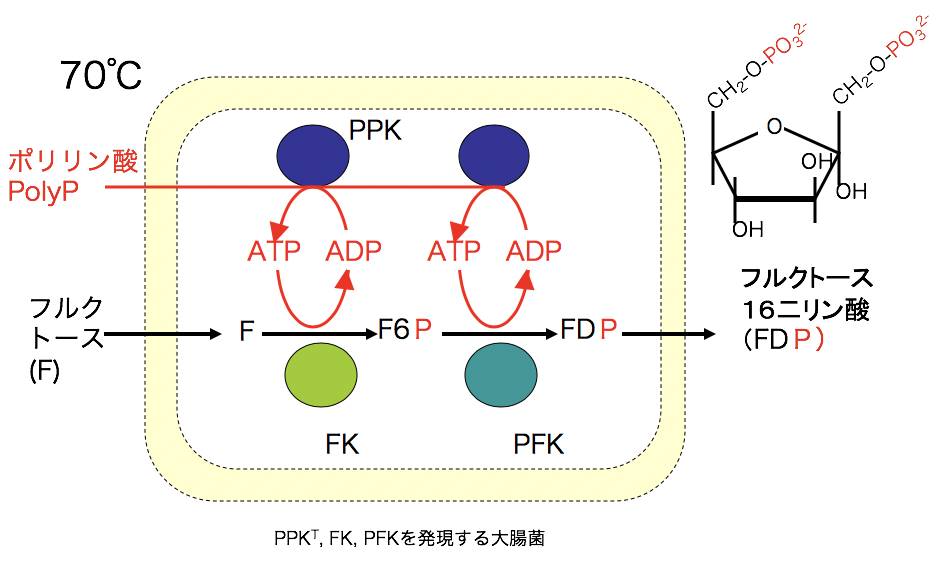
我々はポリリン酸を使ってATPを作り続ける大腸菌を作った。これは、耐熱性PPKを大腸菌で発現させた菌液を70℃、10min加熱処理し、ポリリン酸を加えたものである。外からポリリン酸が取り込まれ、連続的にATPを合成する。ATPを利用する酵素をATPを作り続ける大腸菌の中で共役させることで、連続的にもの作りが可能になる。
また、我々はAMPからATPを作るPPK2を発見した(AMP→ADP→ATP)。この酵素を使えばポリリン酸を使ったもの作りがさらに広がると考えている。
論文
S. Iwamoto, et al., Appl. Environ. Microbiol. 73, 5676-5678 (2007)
K. Motomura, et al., Appl. Environ. Microbiol. 80, 2602-2608 (2014)
ポリリン酸は非常に安価な材料。リン酸ナトリウムなどを加熱すると脱水縮合して簡単にポリリン酸が生成します。ATPと比較すると、1/1000以下の価格で作れます。我々の見つけた好熱菌ポリリン酸キナーゼとポリリン酸によるATP再生は、世界で最も安価で安定なATP再生系といえるでしょう。
ATP増幅反応
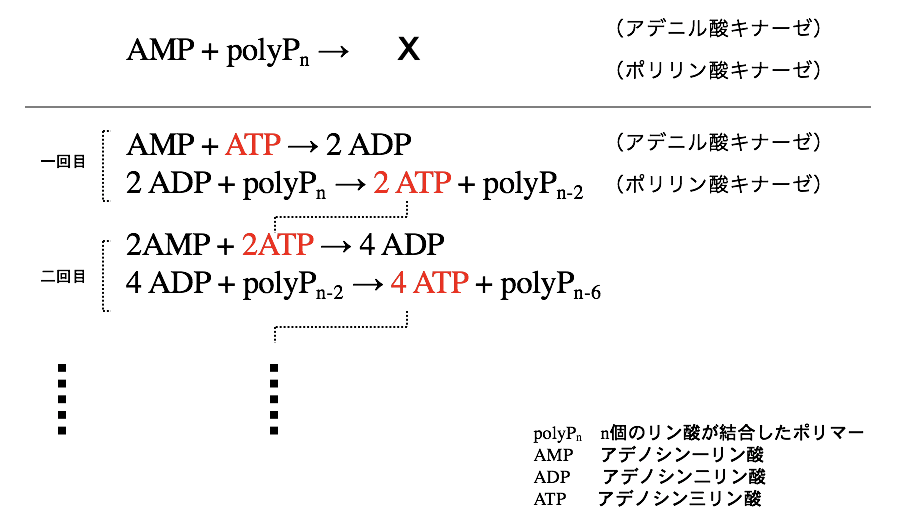
ポリリン酸による生命エネルギー再生系を使って、試験管の中で微量のATPを増幅させる反応を考案した。最初にポリリン酸(polyP)とアデノシン一リン酸(AMP)とアデニル酸キナーゼ、ポリリン酸キナーゼを混合しておく。その状態ではATPができないが、反応系に少量のATPを加えると、即座にアデニル酸キナーゼによって、二分子のアデノシン二リン酸(ADP)が生じる。できたADPはポリリン酸とポリリン酸キナーゼによって、二分子のATPに変換される。この反応が繰り返されて、多量のATPが数分のうちに作られる。微量のATPを増やして検出するため、高感度にATPが検出できる。
しかし、上記のATP増幅反応の欠点は、一度反応が開始すると連鎖的に反応が進むので回数の制御ができず、もとに存在したATPの逆算が困難であることであった。そこで、この回数制御を可能にするために、アデニル酸キナーゼによる第一反応とポリリン酸キナーゼによる第二反応を流路(あるいはカラム)で分割し、増幅回数を制御できる様にした。通過回数を制御することによって、ATPの増幅回数が制御できた。
論文
T. Satoh, et al., Biosci. Biotechnol. Biochem. 68, 1216-1220 (2004)
T. Satoh, et al., Anal. Biochem. 395, 161-165 (2009)
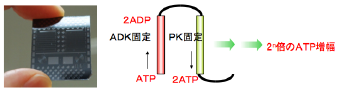
ATP増幅反応は我々のオリジナル技術である。我々の独創的なATP増幅技術を発展させることによって、将来的に一分子のATPの検出も可能であると考えている。
ATP関連の仕事、高輝度ルシフェラーゼの開発
ホタル由来のルシフェラーゼは、大まかに言うと1秒に1回光る。しかし、これは酵素としては、とてつもなく効率が悪い。1秒に何百回と仕事をする酵素がザラである。これはルシフェラーゼが実は進化的に未熟な酵素なのか、あえてホタルの中では光すぎない様にしているのかまだ分からないが、何れにしても人工的な進化により効率のいい酵素へと変貌させられる可能性を示している。
そこで、試験管内でルシフェラーゼに変異を導入して人工進化を試みた(物産ナノテク研究所)。人工進化とは、変異によってより光るものが得られれば、それをもとに、より光る変異を導入する。それを繰り返して、より光るものを選抜する。その結果、15倍の発光を示す酵素を作り出すことに成功した。この酵素は、ルシフェラーゼFM(US patent 8003350)として、バイオエネックス社から販売されている。
高輝度ルシフェラーゼの応用
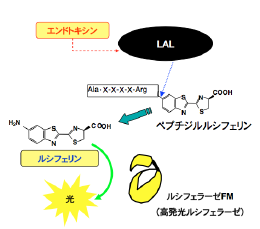
エンドトキシンは細菌の細胞壁構成成分の一種で、注射輸液や人工透析等で直接血液中に混入すると発熱やショック症状等を引き起こす。エンドトキシンは熱に安定で、細菌死滅後も残存することから、日本薬局方では、細菌検査とは別途に検査を義務づけている。現在、エンドトキシンは、カブトガニ血球タンパク質成分(LAL)を使用し、濁度や比色変化によって検査されている。しかし、現状では定められた感度を達成するために、測定に120分以上かかっている。我々は、同様にLALを用いるが、最終反応に濁度や比色ではなく、我々の独自技術である発光技術を応用することによって、高感度化を達成した。すなわち、LALによる反応は、エンドトキシン特異的に活性化されるプロテアーゼカスケード系反応であることから、反応基質にペプチドを付加したルシフェリンを使用した。反応によって遊離する極微量のルシフェリンをルシフェラーゼの発光測定することにより、高感度エンドトキシン検出に成功した。これにより比色法の100倍以上の感度を有し、超微量のエンドトキシンを15分程度で検出することが可能となった。
論文
H. Fujii, et al., Anal. Biochem. 366, 131-136 (2007)
K. Noda, et al., Anal. Biochem. 397, 152-155 (2010)
バイオエネックス社のHP