はじめに
我々は、バイオ分子とシリコン系材料との融合、あるいはバイオ技術とシリコンナノテクノロジーの融合を志向し、シリコン結合タンパク質を取得した。シリコン結合タンパク質と目的タンパク質との融合タンパク質を作製することによって、任意のタンパク質をシリコン基板上やシリカに固定化することが可能になってきた。従来の物理吸着法や共有結合法に比べ、タンパク質の活性の維持や配向性、さらには操作の容易性などの優位性がある。バイオリアクター、酵素センサー、半導体バイオセンサー、プロテインチップ、生体の固定、タンパク質の精製技術への応用可能性について紹介する。
キーワード
シリコン結合タンパク質、固定化、バイオリアクター、バイオセンサー、精製

シリコン結合タンパク質
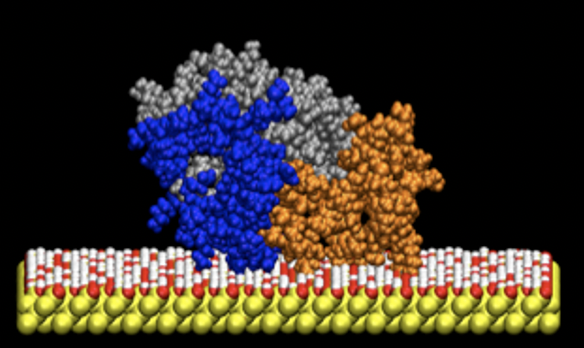
リボソームタンパク質L2(273アミノ酸)は大腸菌破砕液からシリコン粒子(水中でシリコン酸化膜)に強力に結合するタンパク質として見つかった。正確に言えばシリコン酸化膜やシリカに非常に強く結合するタンパク質である。後で判明したが、シリコンだけでなく、酸化チタンなど多くの金属酸化物にも結合する。GFPとL2の融合タンパク質を作製し、シリカに対する親和性を測定したところ、Kd=0.7 nM程度であった。これは、抗体と抗原の親和性と同程度である。既存のシリカ結合ペプチドとしてポリアルギニンタグが報告されていたが、ポリアルギニンタグを付加したGFPのKdは数十nMであることから、L2はこれまでになく強力なシリコン結合タンパク質だと言える。
L2のシリコン結合領域は、N末端側とC末端側にあるが、これらの領域は溶液中で特定の立体構造をとらない「天然変性(あるいは不定形)」であることが判明した。天然変性領域は、通常のタンパク質のような球状の立体構造をとらず、溶液中ではひらひらとしたリボンのような動的な状態で存在していると考えられている。分子動力学シミュレーションの結果,L2の天然変性領域に含まれる多くのアルギニン・リジン残基が,シリカ表面のシラノール基と多点で結合していることが示された。つまりL2はポリペプチド鎖がほどけた柔軟な状態で存在しているため、固体表面との接触面積が大きくなり,強固な結合を実現していると考えられた。
論文
K. Taniguchi et al., Biotechnol. Bioeng., 96,1023-1029 (2007).
T. Ikeda, A. Kuroda, Colloids Surf. B: Biointerfaces, 86, 359 (2011)
R. Tosaka et al., Langmuir, 26, 9950 (2010)
シリコン結合タンパク質の応用
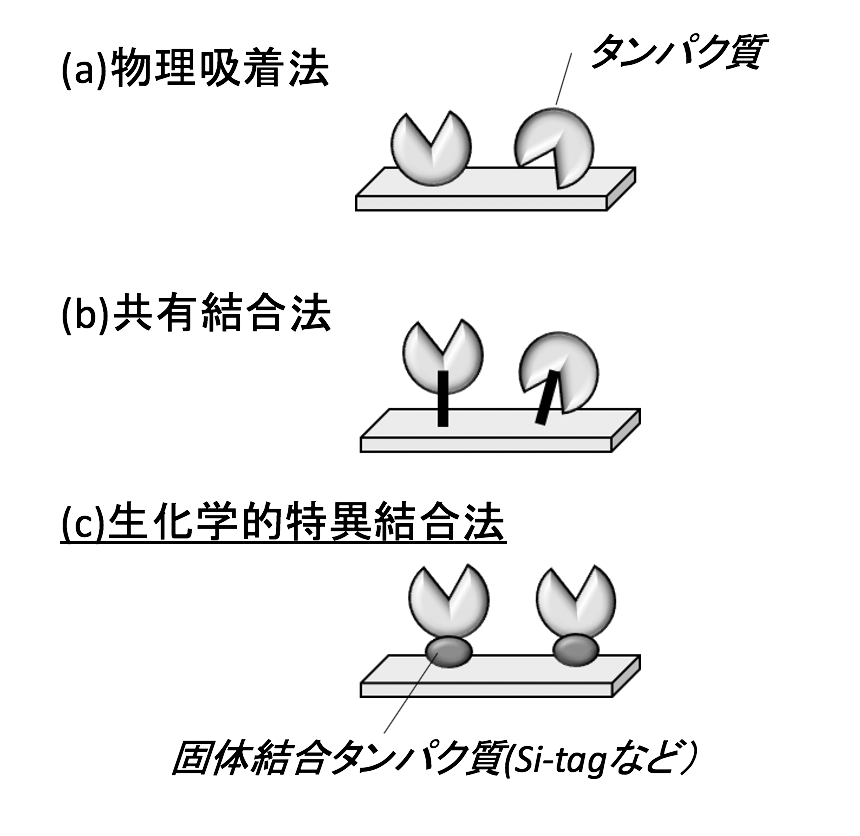
タンパク質を固体表面に固定化する既存の手法としては、物理吸着法や共有結合法があるが、いずれも固定化されるタンパク質分子の配向を制御できないという問題がある。また、固体表面と目的タンパク質が直接相互作用することによるタンパク質の変性などの問題も生じる。一方、シリコン結合タンパク質L2と目的タンパク質との融合タンパク質を作製することによって、任意のタンパク質をシリコン基板やシリカ上に固定化することが可能となる。「L2を付加すればシリコンに行き着く(結合する)」という意味で、Si-tagと名付けた。これまでに様々な派生体を作成している。Si-tagを使った方法は、生化学的特異結合法の一種である。
得られた組換え大腸菌の菌体破砕液に含まれるSi-tag融合タンパク質を取り出してシリコン表面へ固定化するわけであるが、適当な結合条件を選べば(宿主由来の夾雑タンパク質がシリコン表面に結合しない条件を選べば)、精製することなく組換え体の菌体破砕液から直接固定化できる。この方法の利点として、
①固体表面やタンパク質を化学的に修飾する必要がない、
②タンパク質はSi-tagを介して結合するため、目的タンパク質と固体表面の直接的な相互作用によるタンパク質の変性を抑制できる、
③目的タンパク質に融合したSi-tagが固体表面側を向くため、タンパク質分子の配向が揃い、高い活性を保ったまま固定化できる、
④前述の通り、条件を選べばSi-tag融合タンパク質を選択的に固定化できるため、精製の手間を省くことができる等が挙げられる。
論文
T. Ikeda et al., Protein Expr. Purif., 71, 91-95 (2010).
T. Ikeda et. al., Anal. Biochem., 385, 132-137 (2009).
バイオリアクター
酵素を工業的な物質生産に利用する場合、酵素を不溶性の担体に固定化した固定化酵素が広く用いられている。酵素を固定化するのに適した足場材料として、多孔質シリカ、特に規則性ナノ空間を有するメソポーラスシリカの利用が検討されている。メソポーラスシリカの規則性細孔を利用した固定化技術では、複数の異なる酵素を10 nm以内の近接状態で安定的に配列化できることが分かっている。また、固定化に伴い、酵素の熱安定性の向上や酵素同士の凝集の抑制などの効果があることが知られている。Si-tagを利用することで、より効率的かつ安定にメソポーラスシリカを担体とした酵素の固定化が実現できる(産総研との共同研究)。
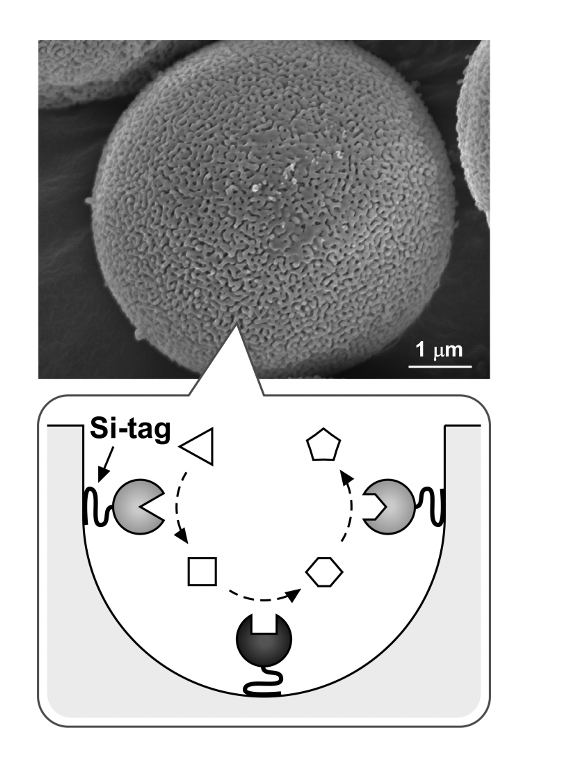
Si-tag protein Aを用いた抗体の固定化
シリコンナノワイヤやカンチレバーを利用した新たな半導体センサーが続々と発表されている。半導体バイオセンサーを作製する上で、分子認識層として抗体をデバイス上に固定化することは非常に重要なステップである。抗体の抗原結合部位を液相側に配向させた形でシリコン上に固定化するために、抗体のFc領域と結合するProtein AとSi-tagの融合タンパク質(Si-tag protein A)を作製した。Si-tag protein Aをシリコン基板に固定化した後に抗体を添加すると、Si-tag protein Aを介して抗体が基板上に固定化された。Si-tag protein Aによって抗体分子が配向的に固定化されることで、物理吸着による固定化に比べ、高い抗原結合活性を示すことが分かっている。
シリコンリング光共振器に、Si-tag protein Aを介して抗体を固定化することで、半導体バイオセンサーの構築に成功している(広島大学のナノデバイスバイオ融合研究所と共同研究)。
論文
T. Ikeda et. al., Anal. Biochem., 385, 132-137 (2009).
M. Fukuyama, et al., Jpn. J. Appl. Phys., 50, 04DL07 (2011).

タンパク質の精製技術
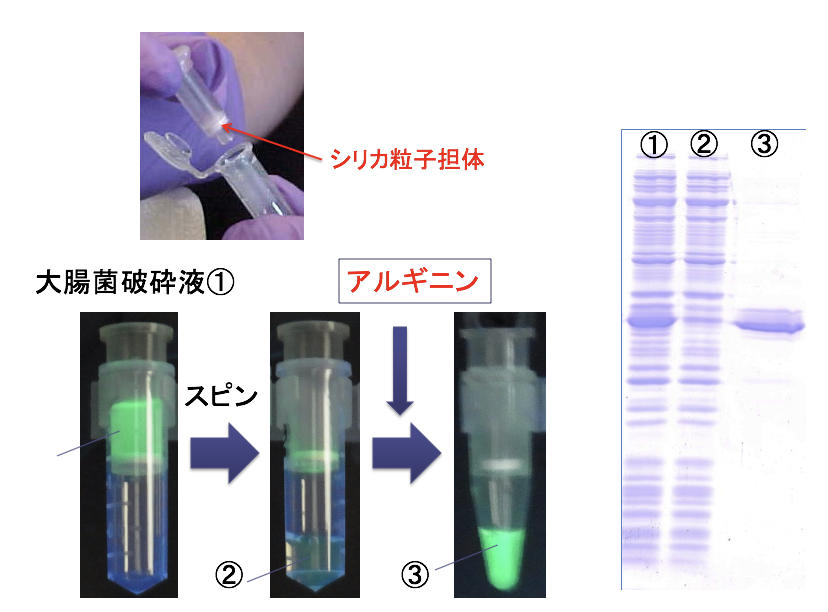
シリコン結合タンパク質を用いて目的タンパク質を精製することもできる。Si-tag-7 (RQSSRGR)は、シリカ粒子を用いた精製用のタグとして利用できる。結合メカニズムを解析した結果、Si-tag-7に含まれる3つアルギニン残基が結合に重要であることが分かった。さらに、0.5 M程度のアルギニンを含む溶液を添加することで、シリカに結合したSi-tag-7融合タンパク質を競合的に溶出できることが明らかとなった。
シリカはカオトロピック塩の存在下において核酸(DNAやRNA)を吸着するため、核酸精製の担体としても用いられている。代表的な例では、膜状シリカを備えたスピンカラムを用いることで、簡便にプラスミドDNAやPCR産物などを精製するためのキットが販売されている。そこで、Si-tag-7を融合したGFPを発現した組換え大腸菌の菌体破砕液を市販のシリカスピンカラムに添加して遠心した。その後、アルギニン溶液を添加して遠心することで、容易に目的タンパク質を精製することができた。なお、この条件では核酸はシリカに吸着しないため、Si-tag-7が付加されたタンパク質のみを高純度に精製することができる。
担体としては合成シリカのみならず、天然鉱物であるシラス(九州南部に広く分布する火山灰)も利用可能であることが分かった。安価な天然鉱物を担体として利用すれば、His-tag精製などの既存のアフィニティー精製法に比べ非常に低コストでの精製を実現できる。また、本精製法で溶出に用いるアルギニンにはタンパク質の凝集を抑制し、安定化させるという効果があるため、凝集しやすい不安定なタンパク質の精製にも有効だと期待される。また、シリカを担体とした核酸の自動精製装置も販売されているため、それを利用することでタンパク質精製の自動化も可能であると考えられる。
論文
M.A.A. Abdelhamid et al., J. Biosci. Bioeng., 122, 633-638 (2016).




